
人胚胎干细胞具有分化为体内几乎所有细胞类型细胞的能力,包括分化多种类型的血管细胞。血管平滑肌细胞是血管的主要细胞成分,对维持血管壁的完整性和血管功能至关重要。人多能干细胞衍生的血管平滑肌细胞可用于血管疾病模型建立、药物研发和血管组织工程,有广泛的应用价值。干细胞分化需要多种转录因子协同调控。转录因子BACH1 (BTB and CNC homology 1)广泛存在于哺乳动物组织中,在多种心血管疾病中发挥重要调控作用。2019年,孟丹教授研究团队在Science Advances上发表的研究中,揭示了BACH1是干细胞维持自我更新和决定谱系分化中的关键调控因子。该团队后续在Nucleic Acids Research上的研究还证实BACH1是干细胞维持自我更新和早期分化过程中的关键转录调控因子,这为了解干细胞的命运决定机制提供了重要的线索。然而,BACH1在干细胞向血管平滑肌细胞分化过程中的作用尚不清楚。
2023年11月20日,复旦大学孟丹教授团队在Cell Reports上在线发表题为BACH1 regulates the differentiation of vascular smooth muscle cells from human embryonic stem cells via CARM1-mediated methylation of H3R17的文章。该研究首次揭示了转录因子BACH1在调控人胚胎干细胞向血管平滑肌细胞分化中的重要作用及机制,对理解干细胞定向分化至血管细胞过程中阶段性的调控机制具有重要启示,可能为开发干细胞治疗血管疾病的临床应用提供新思路。

研究人员发现,在诱导人胚胎干细胞向血管平滑肌细胞分化的过程中,BACH1的表达逐渐升高。干细胞中BACH1的缺失会降低分化细胞中平滑肌标志基因的表达,并降低干细胞向平滑肌细胞分化的效率。而在中胚层分化阶段后诱导BACH1过表达能够上调分化细胞中平滑肌标志基因的表达。进一步发现,BACH1在由人胚胎干细胞向平滑肌细胞分化的过程中扮演着重要角色: BACH1富集在平滑肌标志基因启动子区,上调其基因表达。机制上,研究人员发现了BACH1在调控组蛋白甲基化修饰方面的新作用。BACH1在体外平滑肌分化过程中直接与共激活因子相关精氨酸甲基转移酶1 (CARM1)结合,这种相互作用是由BACH1的bZIP结构域介导的。BACH1将CARM1招募到平滑肌标志基因启动子区,通过增加组蛋白3第17位精氨酸二甲基化(H3R17me2)修饰,促进平滑肌标志基因表达,从而促进干细胞中胚层分化阶段后的平滑肌分化。抑制CARM1或H3R17me2阻碍了过表达BACH1促进的平滑肌标志基因表达,说明BACH1通过CARM1和H3R17me2调控平滑肌分化。这些发现强调了BACH1通过CARM1介导的H3R17me2修饰在干细胞向血管平滑肌细胞分化中起到的关键作用。
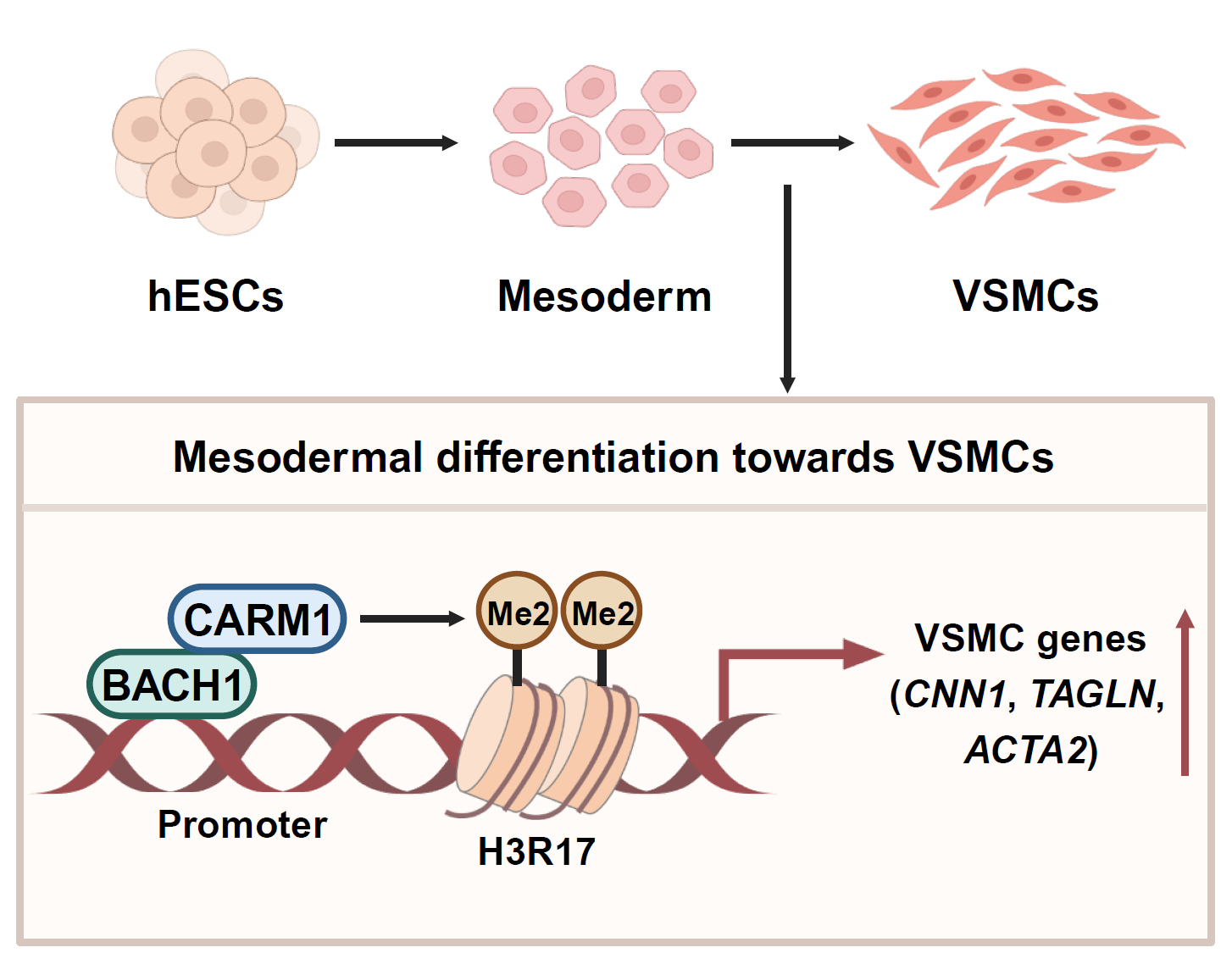
BACH1调控人胚胎干细胞向血管平滑肌细胞分化的机制示意图
这项研究表明,转录因子BACH1对人胚胎干细胞中胚层阶段后的体外血管平滑肌细胞分化起正向调节作用。该研究为干细胞定向分化至血管细胞的机制提供了新的见解。结合之前的研究,证明BACH1在干细胞自我更新、中胚层和血管谱系分化过程中起重要作用,对于再生医学领域的相关研究具有重要的科学意义。
williamhill官网何韫荃博士研究生和郭阶雨博士后为本文的共同第一作者,williamhill官网孟丹教授、魏香香青年副研究员和王新红副教授为本文的共同通讯作者。该研究得到了瑞士苏黎世大学Elena Osto教授等人的大力支持;同时得到了来自国家自然科学基金重大研究计划重点项目,国家自然科学基金重点国际合作项目、上海市优秀学术带头人项目、上海市科委科技创新行动计划以及上海市科委启明星项目和复旦大学卓识杰出人才项目等基金的资助。





