
心血管疾病是全球居民死亡的首要原因。动脉粥样硬化是心血管疾病的最主要病因,它可导致心肌梗死、脑卒中、主动脉瘤等致残、致死性后果。血管内皮细胞功能紊乱和血管炎症是动脉粥样硬化发生的首要环节。动脉斑块好发于动脉分支处和弯曲的部位,这表明血流异常产生的血流剪切力变化是内皮细胞功能紊乱的重要诱因。探究振荡血流剪切力诱导内皮细胞功能紊乱的关键分子并明确其调控网络,对寻找干预动脉粥样硬化的新的治疗靶点具有重要意义。
2022年2月24日,williamhill官网孟丹教授团队与复旦大学附属浦东医院余波教授团队合作在《循环研究》(Circulation Research)杂志在线发表了题为《BACH1基因缺失通过减少内皮炎症减轻动脉粥样硬化》(“Deletion of BACH1 Attenuates Atherosclerosis by Reducing Endothelial Inflammation”)的最新研究成果,这项工作揭示了转录因子BACH1(BTB and CNC homology 1)作为血流动力学机械传感器的新功能,并阐明了BACH1在调控动脉粥样硬化发生和发展中的重要作用及机制。研究结果对理解振荡血流剪切力诱导内皮细胞功能紊乱和动脉粥样硬化发生发展过程具有重要启示,可能为抗动脉粥样硬化治疗提供新思路。

全基因组关联研究(genome-wide association studies, GWAS)已发现与冠心病发病相关的多个基因多态性位点,为冠心病的易感人群及患者的预防及诊治提供了新的依据,但这些多态性位点影响动脉粥样硬化发生的机制尚不明确。孟丹教授研究团队前期在《循环研究》(Circulation Research)上发表的研究中证实了BACH1抑制缺血性疾病血管新生的新作用和新机制,但是BACH1在动脉粥样硬化中的作用及机制尚不清楚。研究人员首先对颈动脉粥样硬化斑块病人的冠心病相关基因单核苷酸多态性进行了研究,发现冠心病风险位点rs2832227单核苷酸多态性与BACH1基因表达密切相关,并且BACH1在有症状患者的颈动脉斑块中高表达,BACH1在人和小鼠的动脉粥样硬化斑块内皮高表达。
血液在血管内的流动方式分为层流和湍流。人体的血液循环在正常情况下属层流模式,但在血管分支处、创伤部位造成的血流扰动区域会形成湍流,湍流带来的血液与血管内壁摩擦力又称“振荡剪切力”。进一步的研究发现,BACH1在湍流较高的小鼠主动脉弓部高表达,振荡血流剪切力会增加内皮细胞BACH1的表达,从而促进相关黏附因子和炎症因子的表达,促进内皮的炎症反应。在用颈动脉部分结扎术造成血流紊乱从而诱导动脉粥样硬化的动物模型中,内皮特异性敲除BACH1基因的小鼠颈动脉斑块形成显著减少,内皮炎症反应明显减轻,表明BACH1在动脉粥样硬化的发生发展中扮演着非常重要的角色。
通过基因转录组和染色质免疫沉淀-测序分析发现,BACH1结合在Hippo信号通路效应分子YAP基因启动子区并促进YAP的表达。振荡血流剪切力或炎症因子刺激人血管内皮细胞BACH1与YAP的结合并进入细胞核,促进下游黏附因子及炎症因子的表达,进而促进单核细胞与内皮细胞的黏附。内皮特异性过表达YAP可阻断BACH1缺失小鼠的抗动脉粥样硬化作用,提示BACH1-YAP调控网络在促进内皮细胞炎症和动脉粥样硬化中发挥重要作用。最后研究人员筛选BACH1的抑制剂发现他汀类药物可显著抑制小鼠动脉粥样硬化斑块内皮BACH1的表达,不仅从调控BACH1的角度揭示了他汀类药物治疗动脉粥样硬化的新机制,而且进一步明确了调控BACH1表达的药理学意义。这项研究表明BACH1作为新的血流动力学机械传感器,激活内皮细胞炎症并促进动脉粥样硬化发生发展,BACH1有可能成为防治心血管疾病的新靶标。
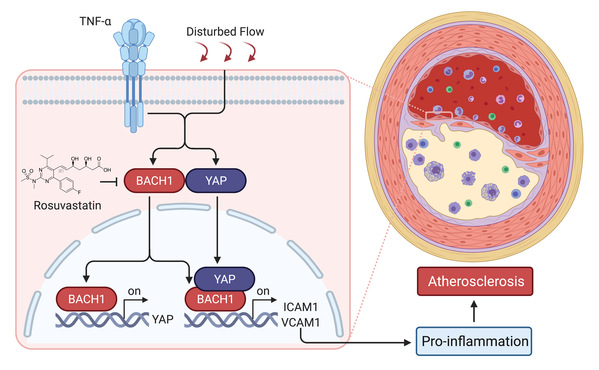
BACH1介导内皮细胞炎症和动脉粥样硬化发生的机制图
复旦大学博士后贾孟萍,复旦大学博士研究生李沁函、郭阶雨和复旦大学附属华山医院史伟浩主任为本文的共同第一作者,williamhill官网孟丹教授、复旦大学附属浦东医院余波教授和williamhill官网王新红副教授为本文的共同通讯作者,复旦大学为第一作者单位。该研究得到了香港城市大学黄聿教授和王力教授,上海交通大学附属瑞金医院王晓群教授,中国科学院上海生命科学研究院荆清研究员,同济大学附属东方医院张玉珍教授,北京大学基础医学院孔炜教授和李芷晴博士等人的大力支持;得到了来自国家自然科学基金重大研究计划重点项目和面上项目,上海市科委科技创新行动计划,上海市优秀学术带头人项目以及复旦大学卓识杰出人才项目等基金的资助。





