
肿瘤细胞的特征之一是可以通过表达免疫抑制性配体来实现免疫逃逸,同时这也成为肿瘤细胞的一个弱点(Andrews LP, et al, Nat Immunol, 2019),靶向免疫检查点分子的单克隆抗体可以促进肿瘤免疫,并在多种癌症治疗中显示出临床益处(Ribas A and Wolchok JD, Science, 2018)。在一些实体瘤中,阻断免疫抑制性受体或配体(如PD-1和PD-L1)的治疗手段在临床治疗中的响应率为30%-40%,但在肝细胞癌(HCC)中仅有15%-20%的患者响应免疫检查点抑制剂治疗,并延长生存期(Sangro B, et al, Nat Rev Gastroenterol Hepatol, 2021)。因此,针对HCC患者开发更有效的免疫治疗方案是目前亟待解决的问题。
2023年5月1日,williamhill官网生化系代谢分子医学教育部重点实验室吕雷团队与同济大学徐艳萍团队联合在J Clin Invest上以Research article形式发表了题为Targeting fibrinogen-like protein 1 enhances immunotherapy in hepatocellular carcinoma的研究成果,并被JCI This Month作为亮点报道。该研究揭示去乙酰化酶SIRT2抑制剂(AGK2)或阿司匹林,能够促进FGL1的乙酰化修饰,从而促进其降解,提高HCC免疫治疗的效果。同时,J Clin Invest同期配发了由美国贝勒医学院Ganesh Rao教授撰写的评论(Aspirin and immunotherapy: a Faustian bargain?),对该研究进行了专题评述。

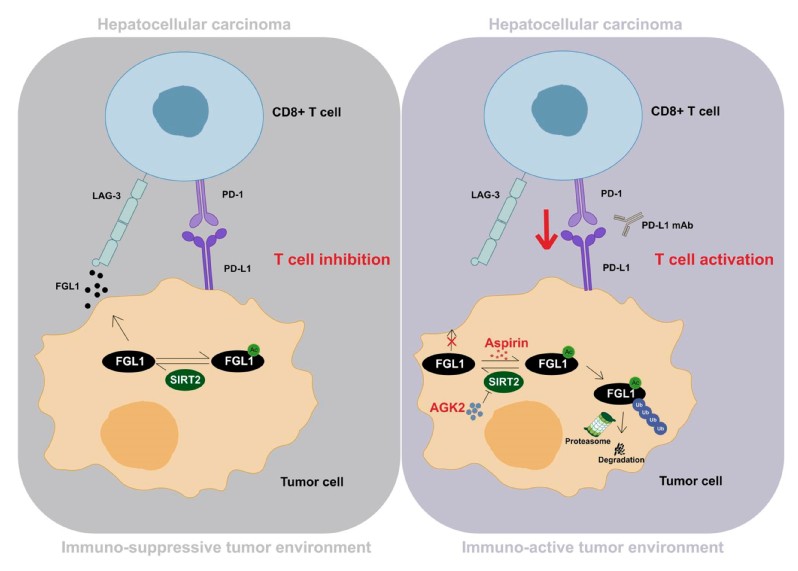
2019年,陈列平教授团队发现FGL1蛋白是LAG-3的免疫抑制性配体 (Wang J et al, Cell,2019),能够帮助肿瘤细胞逃避免疫监视。在靶向PD-L1/PD-1通路的同时靶向FGL1/LAG-3通路,是一种双管齐下的免疫治疗策略。
非组蛋白的赖氨酸(K)乙酰化是一种进化上保守的翻译后修饰(PTM)。越来越多的证据表明,乙酰化能够使蛋白质以一种精确而有效的方式调控细胞信号传导等生物学过程。考虑到FGL1在肿瘤免疫逃逸中扮演着重要角色,研究人员尝试探索FGL1蛋白是否具有乙酰化修饰,及其介导的潜在生物学功能。通过使用去乙酰化酶抑制剂TSA和NAM,研究人员发现FGL1蛋白存在乙酰化修饰,并且乙酰化促进FGL1蛋白的降解。通过筛选,确定去乙酰化酶SIRT家族成员SIRT2可以稳定FGL1的蛋白水平。深入的机制研究发现,SIRT2通过对FGL1蛋白的K98位点去乙酰化帮助FGL1蛋白抵抗泛素化降解。进一步的探索发现,阿司匹林能够直接乙酰化FGL1蛋白的K98位点,并且促进FGL1蛋白通过泛素蛋白酶体途径降解。在多种小鼠HCC模型中,SIRT2抑制剂(AGK2)或阿司匹林与PD-L1抗体联合治疗显著延长了荷瘤小鼠的生存期,增加了瘤体中CD8+T细胞的浸润和颗粒酶B的表达。最后,研究人员通过分析HCC病人的组织样本发现:与癌旁组织相比,SIRT2在HCC组织中高表达,并且随着肿瘤临床分期增加,SIRT2表达水平显著提高。同时,FGL1蛋白K98位点的相对乙酰化水平随着肿瘤分期的增加而显著降低。进一步的分析表明,SIRT2的低表达或FGL1蛋白K98位点的高乙酰化水平与较好的患者预后相关。该研究总体揭示了SIRT2介导的FGL1蛋白K98位点的去乙酰化在临床上的重要意义。
总结来说,该研究首次报道了FGL1蛋白的乙酰化修饰,揭示了SIRT2-FGL1调控轴,以及FGL1 K98位乙酰化修饰在肝癌中的临床意义,发现AGK2靶向SIRT2能够促进FGL1蛋白降解,改善肿瘤免疫治疗的效果。同时,还挖掘了阿司匹林在HCC免疫治疗中的应用潜力,为HCC的临床治疗提供了新策略。
作者信息:williamhill官网2019级直博生林铭恩为本文的第一作者。williamhill官网吕雷研究员、同济大学生命科学与技术学院徐艳萍教授为共同通讯作者。复旦大学为第一作者单位。
原文链接:
https://www.jci.org/articles/view/164528





