
可变剪接 (Alternative Splicing, AS) 普遍存在于真核多细胞生物,在多种生理过程中发挥着重要功能。剪接因子通过与RNA前体上的序列元件相互作用,在可变剪接调控中发挥核心作用。剪接异常是导致人类遗传疾病的主要原因之一,并被证实与肿瘤发生、发展、药物耐受等紧密相关。因此,阐明剪接因子的表达调控机制,特别是其稳态维持及交叉调控网络,具有广泛的生理、病理意义。
RBM10是一个RNA结合蛋白及剪接因子,其蛋白截短突变导致一种多器官发育异常遗传疾病——TARP syndrome,且其突变在以肺腺癌为代表的多种肿瘤中高频率出现。王勇波及其团队的前期研究揭示了RBM10介导可变剪接的分子机制,并对肺腺癌相关的RBM10突变进行了系统的功能分析。在此基础上,该团队进一步揭示了RBM10自我调控及交叉调控RBM5的分子机制。相关论文以《RBM10通过可变剪接偶联无义介导的mRNA降解途径自我调控及交叉调控RBM5》 (Autoregulation of RBM10 and cross-regulation of RBM10/RBM5 via alternative splicing-coupled nonsense-mediated decay)为题在线发表于《核酸研究》 (Nucleic Acids Research) 上。青年副研究员王勇波和德国Zuse Institute Berlin 的Xintian You博士为论文通讯作者,博士研究生孙悦为第一作者。
研究发现RBM10通过促进自身及RBM5特定的外显子剪接排除 (exon skipping),触发无义介导的mRNA降解途径 (Nonsense-mediated mRNA decay, NMD),从而实现对自身及RBM5的负向调控(图1A);建立了基于RNA-Seq与CLIP-Seq数据整合分析、能广泛应用于AS-NMD介导的剪接因子自我及交叉调控机制研究的方法;发现肺腺癌中介导RBM10自我调控的外显子存在剪接位点突变,且这些突变导致其表达量显著下降 (图1B)。这些研究结果将为RBM10在不同生理、病理条件下的功能及作用机制研究提供重要启示,并将促进剪接因子表达调控机制研究领域的进展。
合作单位有中科院计算生物学研究所王泽峰研究员团队、南方科技大学生物系陈炜教授、细胞与遗传医学系David Saffen教授与左伋教授团队。此项目受国家自然科学基金及复旦大学科研启动基金支持。
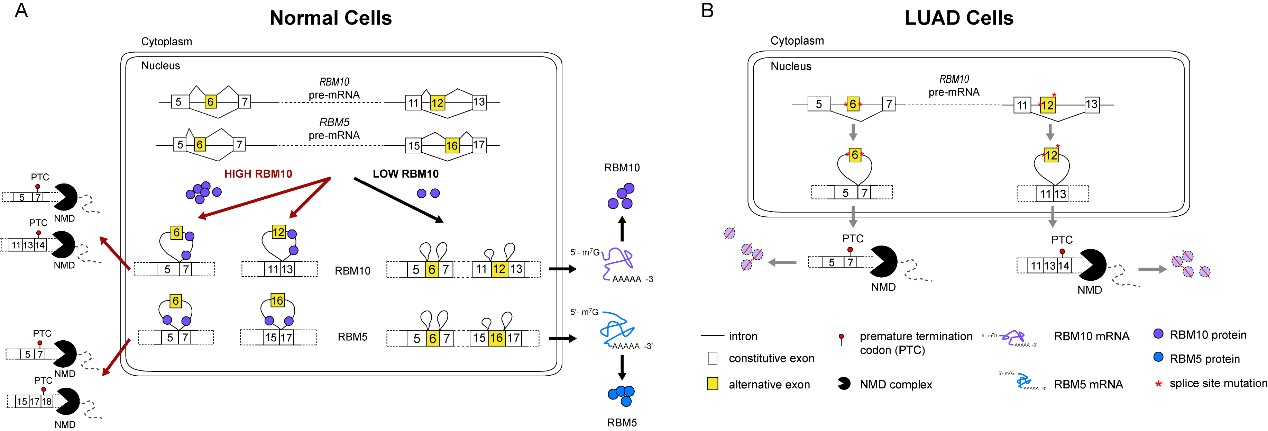
图1. RBM10调控自身及RBM5表达的分子模型
供稿:孙悦,王勇波,细胞与遗传医学系





