
乙肝病毒(HBV)慢性感染仍然是威胁人类健康的重大公共卫生问题。一般认为,HBV自身不具有直接的肝细胞毒性,慢性肝炎可能反映了机体不充分的抗病毒免疫效应,以及这一效应对肝组织的持续病理损伤。然而,上述观点需要在特定的病理生理条件下重新检视,例如自然发生的 HBV 基本启动子(BCP) 以及前C区突变,与重症肝炎或终末性肝病发生高度相关,但相关分子机制仍不清楚。
近日,williamhill官网医学分子病毒学教育部/卫健委/医科院重点实验室暨病原生物学系邓强研究员联合多团队,在Science Bulletin杂志发表题为“Hepatitis B virus core protein as a Rab-GAP suppressor driving liver disease progression”的研究成果。研究者基于HBV重症肝炎相关BCP突变株建立转基因小鼠,与早期报道的野生病毒转基因模型显著不同的是,BCP突变株转基因小鼠具有典型的肝细胞慢性损伤特征,伴随肝硬化和肿瘤发生等进展性病理变化。有意思的是,在上述模型中,低剂量Fas抗体刺激能够诱导广泛的肝细胞损伤,提示转基因小鼠肝细胞对凋亡信号高度敏感。
HBV BCP区突变诱导病毒核心蛋白(HBc)过表达,推测可能具有重要的病理意义。研究者应用串联亲和纯化和蛋白质质谱方法,鉴定到一系列HBc相互作用分子,其中包括线粒体募集的TBC1D15蛋白。深入的研究显示,HBc 过表达能够竞争性抑制线粒体Fis1招募TBC1D15, 抑制氧化应激条件下损伤线粒体的清除;此外,HBc结合TBC1D15以及TBC1D5蛋白保守的TBC催化结构域,在细胞静息状态下增加Rab7活化,持续消耗溶酶体,抑制晚期自噬,并诱导氧化应激条件下的细胞凋亡。值得注意的是,在免疫缺陷的SCID小鼠中,应用腺病毒载体单独表达HBc基因,能够不依赖免疫清除机制、诱导显著的肝细胞损伤。上述研究首次在细胞模型和实验小鼠模型证实HBc具有促细胞损伤特征,提示HBc是慢性乙型肝炎临床治疗的合理靶标。研究者推测,HBV BCP突变株显著刺激线粒体氧化应激反应,同时,过表达的HBc抑制损伤线粒体清除,是重症肝炎发生的重要机制。
williamhill官网医学分子病毒学教育部/卫健委/医科院重点实验室暨病原生物学系邓强研究员,武汉大学病毒学国家重点实验室蓝柯教授,以及上海中医药大学附属曙光医院高月求教授,为论文共同通讯作者。该项目获得国家自然科学基金,上海市市级科技重大专项,以及上海市病原微生物与感染前沿科学研究基地等项目支持。
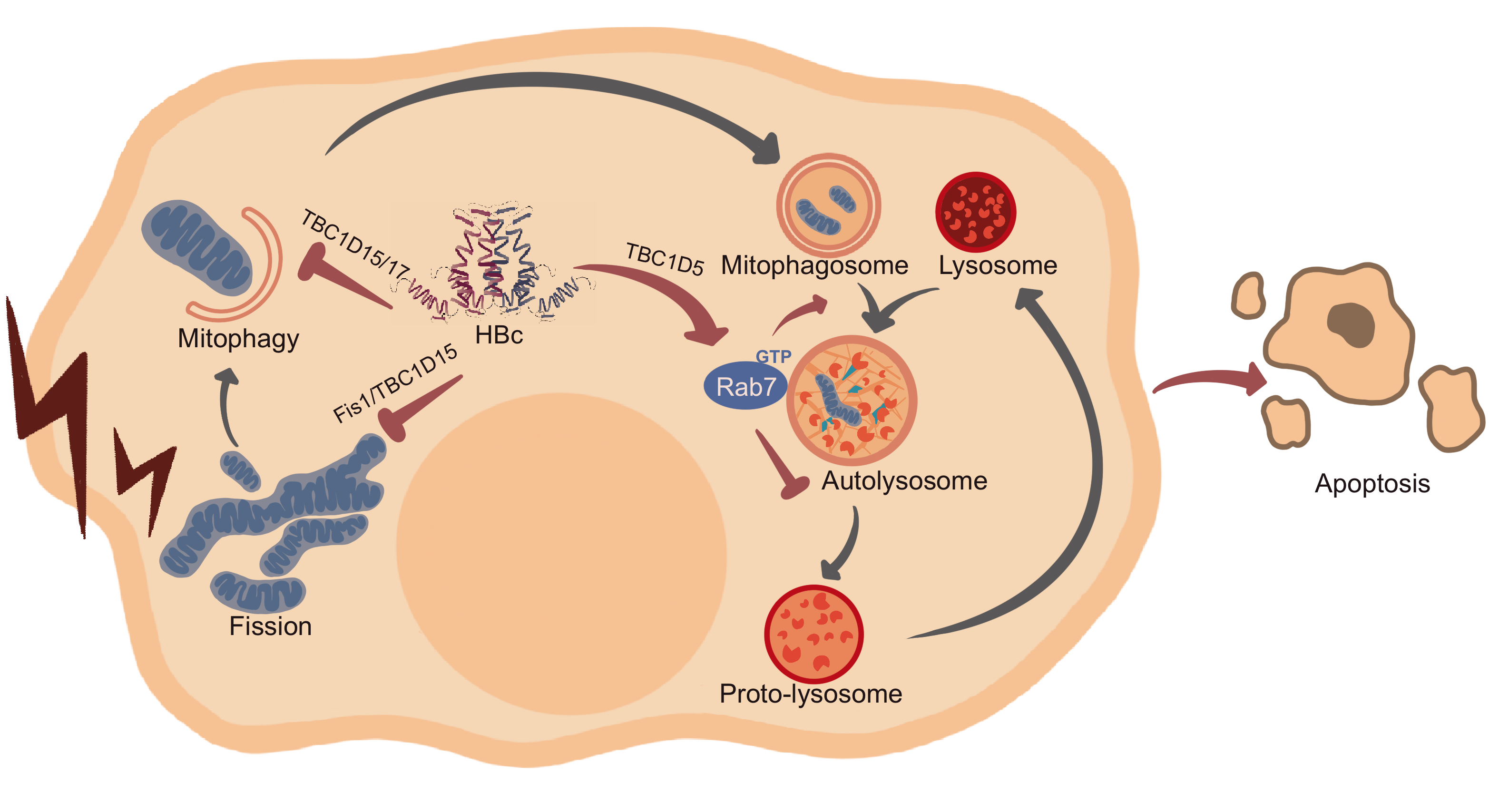
图示:HBV核心蛋白(HBc)细胞损伤效应相关分子机制。





