
药物成瘾是一种慢性复发性脑疾病。精神活性物质滥用引起的中脑边缘系统的结构和功能适应性改变,在成瘾行为的形成和维持中发挥重要作用。因此揭示中脑边缘系统在药物成瘾中的环路、细胞和分子机制对于成瘾防治具有重要意义。近期,williamhill官网马兰院士、王菲菲教授、刘星教授、乐秋旻副教授团队,在药物成瘾及其继代遗传的新的生物学标志物发现上有一系列进展。论文分别发表在中国科学院一区医学期刊Theranostics和Translational Psychiatry及神经生物学专业期刊Progress in Neurobiology上。
腹侧被盖区(VTA)是中脑边缘系统多巴胺神经元的起源地。研究人员以阿片类药物初次暴露激活的神经元集群为切入点展开研究。发现吗啡激活的神经元集群聚集并富集在腹侧VTA,从背内侧纹状体和下丘脑内侧区接收更多的输入,并在内侧区和腹侧苍白球表现出更大的轴突分枝。G蛋白信号通路相关分子PLCg3等在该神经元集群中相对富集。基于G蛋白偏向性信号通路的D2多巴胺受体激动剂卡比拉嗪增加了吗啡激活的神经元集群对自然奖赏的反应,并减少了吗啡戒断时的焦虑样行为,这些发现为阿片类药物滥用引起的情绪障碍干预提供了新的靶点(Wang et al., Theranostics, 2024)。
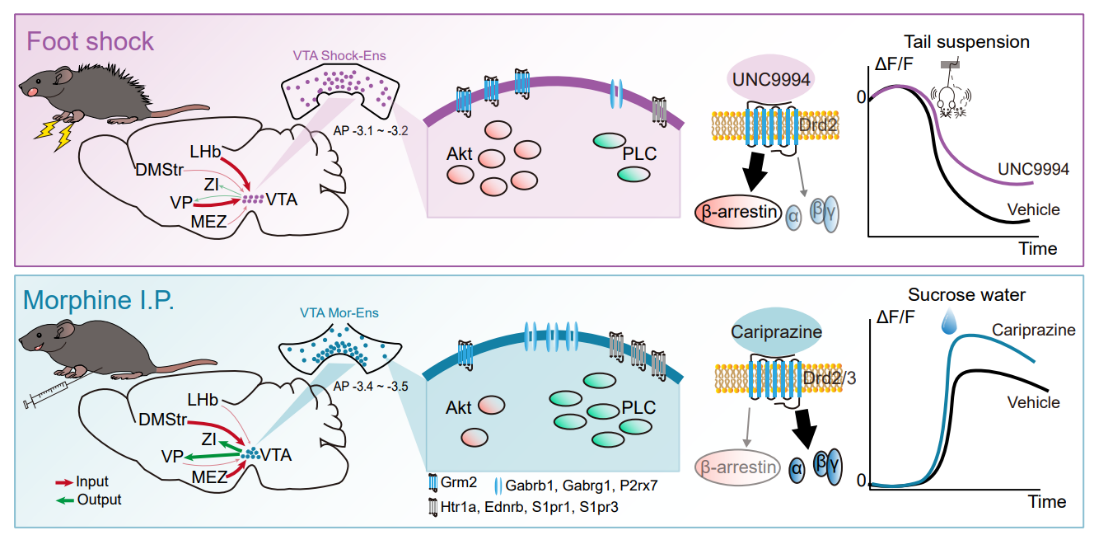
图1 Wang et al., Theranostics, 2024
线索诱发的可卡因渴求会在药物戒断后逐渐增强,这种现象被称为药物渴求孵育现象。在这一过程中,初次使用可卡因所激活的神经元集群起到了关键作用。然而,戒断过程中该神经元集群发生的变化如何导致药物渴求孵育的,目前仍未知。研究人员标记了由可卡因条件性位置偏好(CPP)训练激活的伏隔核壳部(NAcSh)的神经元集群。在这群细胞中,多巴胺D1受体表达的神经元树突棘密度在戒断 21 天后有所增加。N-甲基-D-天冬氨酸(NMDA)受体亚基Grin1的表达在可卡因戒断后在NAcSh集合中特异性增加。上述研究揭示了药物渴求长期存在和成瘾复发的细胞基础和分子机制(Huai et al., Progress in Neurobiology, 2024)。
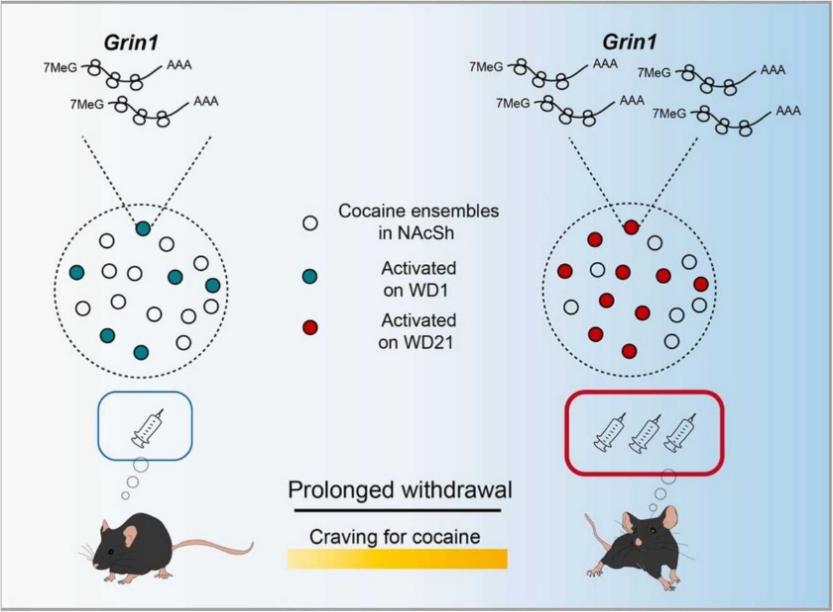
图2 Huai et al., Progress in Neurobiology, 2024
流行病学调查显示,祖代药物依赖病史会增加后代成瘾的风险。研究人员对子代成瘾易感的环路基础和关键靶点进行了研究。对可卡因成瘾大鼠和被动给药大鼠子代中脑边缘系统7个核团进行了转录组测序,并比较生理状态下和可卡因暴露后的转录组动态变化,确定了VTA在可卡因成瘾易感性代际遗传中的关键作用(Huang et al., Translational Psychiatry, 2024a)。随后聚焦于VTA,并通过基因表达网络分析的方法找到了导致子代成瘾易感性增加的关键枢纽分子Gabrg3。下调可卡因被动获药子代GABA能神经元的GABRG3表达,可以导致其觅药行为显著增加,并塑造父代高动机觅药跨代遗传效应下的腹侧被盖区的转录组模式,提示腹侧被盖区中间神经元内的Gabrg3在父代高觅药动机获得性遗传中具有关键作用(Cui et al., Translational Psychiatry, 2024b)。这些工作明确了单纯药物暴露与高动机觅药对子代奖赏环路的差异化影响,发现了药物成瘾的代际遗传过程中的关键脑区(VTA)以及关键的分子枢纽(Gabrg3),为后续的研究提供可供进一步探索的方向。

图3 Huang et al., Translational Psychiatry, 2024a &b
基础医学院博士毕业生王帆,槐子晴,何观虹同学, 脑科学研究院博士毕业生崔健,硕士毕业生黄楠分别为这些研究工作的第一作者。该工作受到科技创新2030—“脑科学与类脑研究”重大项目、国家自然科学基金委优秀青年项目及重点等项目的资助。
撰稿人:乐秋旻
原文链接:
Cui, J., Huang, N., Fan, G., Pan, T., Han, K., Jiang, C., . . . Le, Q. (2024). Paternal cocaine-seeking motivation defines offspring’s vulnerability to addiction by down-regulating GABAergic GABRG3 in the ventral tegmental area. Translational Psychiatry, 14(1), 107. doi:10.1038/s41398-024-02835-w
Huai, Z., Huang, B., He, G., Li, H., Liu, Y., Le, Q., . . . Liu, X. (2024). Accumulation of NMDA receptors in accumbal neuronal ensembles mediates increased conditioned place preference for cocaine after prolonged withdrawal. Progress in Neurobiology, 234, 102573. doi:https://doi.org/10.1016/j.pneurobio.2024.102573
Huang, N., Cui, J., Fan, G., Pan, T., Han, K., Xu, K., . . . Le, Q. (2024). Transcriptomic effects of paternal cocaine-seeking on the reward circuitry of male offspring. Translational Psychiatry, 14(1), 120. doi:10.1038/s41398-024-02839-6
Wang, F., Liu, C.b., Wang, Y., Wang, X.x., Yang, Y.y., Jiang, C.y., Le, Q.m., Liu, X., Ma, L., Wang, F.f. (2024). Morphine- and foot shock-responsive neuronal ensembles in the VTA possess different connectivity and biased GPCR signaling pathway. Theranostics, 14(3), 1126-1146. https://doi.org/10.7150/thno.90792.





